دسته بندی عنصرها (گروه های اصلی عناصر در جدول تناوبی)

جدول تناوبی و یا جدول مندلیف چیست؟
جدول تناوبی، نموداری است که تمام عناصر شیمیایی شناخته شده را بر اساس عدد اتمی (تعداد پروتون ها در هسته) آنها به صورت تفکیک شده، دستهبندی میکند. هر عنصر در این جدول دارای نماد و شمارهی اتمی منحصر به فرد است. این چینش منحصر به فرد در جدول تناوبی، الگوهای رفتاری جالبی را در بین عناصر آشکار میکند و به دانشمندان کمک میکند تا خواص عناصر ناشناخته را به راحتی پیشبینی کنند. این عناصر در جدول تناوبی، یا به صورت طبیعی یافت شدهاند و یا به شکل مصنوعی در آزمایشگاه ساخته میشوند. یک جدول تناوبی از 18 گروه یا ستون و 7 دوره یا تناوب تشکیل شده است. از جمله گروه های جدول تناوبی میتوان به گروههای فلزات قلیایی، فلزات قلیایی خاکی، هالوژنها، گازهای نجیب و عناصر واسطه اشاره نمود.
جدول تناوبی به دو بلوک اصلی فلزی و نافلزی تقسیم میشود. فلزات در سمت چپ و پایین جدول قرار دارند و به طور کلی براق، رسانا و چکشخوار هستند. نافلزات در سمت راست و بالا قرار دارند و خواص متفاوتی مانند شکنندگی، عایق بودن و عدم رسانایی الکتریسیته را از خود نشان میدهند.
آموزش شیمی برای تمامی پایهها با بهترین هزینه
تاریخچه پیدایش جدول مندلیف
در سال 1869، شیمیدان روسی دیمیتری مندلیف (Dmitri Mendeleev) جدولی را ارائه داد که به جدول تناوبی مدرن تبدیل شد و شکافهایی را برای عناصری که هنوز کشف نشده بودند، ایجاد کرد. دیمیتری مندلیف در ابتدا، عناصر را بر اساس وزن اتمی آنها مرتب می کرد و اگر آنها در گروه قرار نمیگرفتند، دوباره برای مرتب کردن هر گروه تلاش میکرد. مندلیف خواص برخی از عناصر کشف نشده را پیشبینی کرد و نامهایی مانند «کا-آلومینیوم» را برای عنصری با خواصی مشابه آلومینیوم به آنها داد. بعدها eka-aluminium به عنوان گالیم کشف شد.

سپس در سال 1870، شیمیدان آلمانی لوتار مایر نسخهای از جدول تناوبی مشابه جدول تناوبی مندلیف را ارائه داد. در سال 1882 انجمن سلطنتی لندن مدال Davy را به مندلیف و مایر اعطا کرد. چندین سال بعد، مندلیف عناصر جدیدی مانند گالیم (1875)، اسکاندیم (1879) و ژرمانیوم (1886) را پیش بینی کرد و جدول تناوبی او به رسمیت شناخته شد. در نهایت در سال 1955، عنصر 101 به افتخار این شیمیدان مندلویوم نامیده شد.

در سال 1913، فیزیکدان انگلیسی هنری موزلی از اشعه ایکس برای اندازه گیری طول موج عناصر کمک گرفت و این اندازه گیریها را با اعداد اتمی آنها مرتبط کرد. در ادامه، هنری عناصر جدول تناوبی را بر اساس اعداد اتمی مرتب کرد. این موضوع به توضیح تفاوتها در نسخههای قبلی که از جرم اتمی استفاده میکردند تا حد زیادی کمک کرد.
در سال 2019، یونسکو به مناسبت صد و پنجاهمین سالگرد انتشار مندلیف، آن سال را سال جهانی جدول تناوبی نامگذاری کرد. یونسکو در سایت خود به مناسبت این روز نوشت: «جدول تناوبی عناصر شیمیایی چیزی بیش از یک راهنما یا فهرستی از کل اتمهای شناخته شده در جهان است. این جدول، اساساً دریچهای به روی جهان است که به گسترش درک ما از جهان اطراف کمک زیادی می کند.
مطلب پیشنهادی: چگونه بهترین دانش آموز باشیم؟
ساختار جدول تناوبی
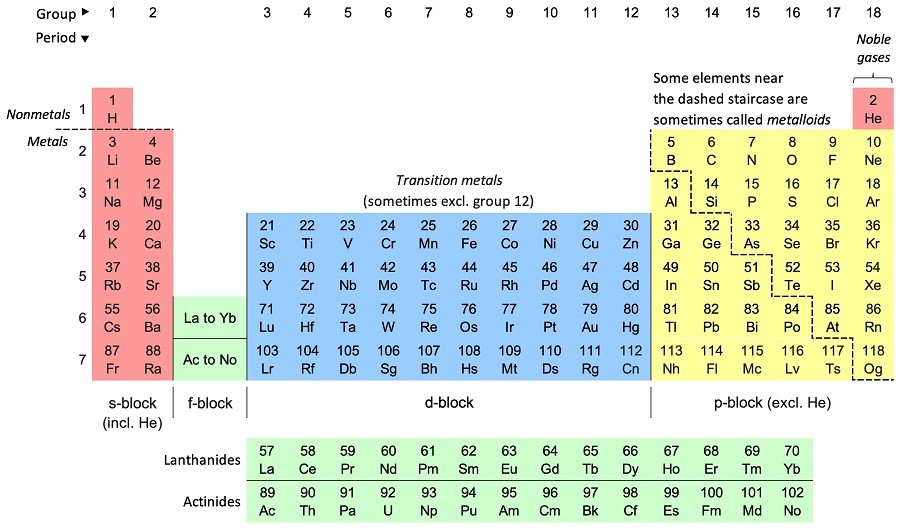
جدول تناوبی ۷ سطر و ۱۸ ستون دارد. در ادامه، به بررسی سطرها و ستونهای این جدول میپردازیم.
سطرهای جدول تناوبی
هر سطح در جدول تناوبی یک دوره و یا تناوب (Period) است. در مجموع 7 دوره در جدول تناوبی وجود دارد که با عدد 1 تا 7 شمارهگذاری میشوند. هر دوره با فلز قلیایی در سمت چپ و گاز نجیب (به جز هلیوم) در سمت راست آغاز میشود.
عدد تناوب یک عنصر، مشخص میکند که چه تعداد از سطوح انرژی، دارای الکترون هستند. برای مثال، اتم سدیم در تناوب سوم قرار دارد و این اتم، معمولاً در سه سطحِ اول انرژی خود دارای الکترون است. با حرکت از بالا به پایین در جدول، طول دورهها بیشتر میشوند. چرا که الکترون بیشتری را برای پر کردن سطوح خارجی دریافت میکنند.
نکات مهم در مورد سطرهای جدول تناوبی
- بلوکهای جدول تناوبی: سطرها در جدول تناوبی به بلوکهای s، p، d و f تقسیم میشوند که بر اساس نوع اوربیتال که آخرین الکترونها را در خود جای میدهد، دستهبندی میشوند.
- استثناها: چند استثنا در قواعد کلی وجود دارد. به عنوان مثال، کروم و مس در گروه 3 قرار دارند، اما آرایش الکترونی آنها با سایر عناصر این گروه کمی متفاوت است.
- اهمیت: سطرهای جدول تناوبی برای درک رفتار شیمیایی عناصر و پیشبینی خواص آنها از اهمیت بالایی برخوردارند.
ستونهای جدول تناوبی
ستونهای جدول تناوبی که به عنوان گروهها نیز شناخته میشوند، از 18 ستون عمودی تشکیل شدهاند که عناصر را با توجه به پیکربندی الکترونی لایه ظرفیتشان، رفتار شیمیایی مشابه و تعداد الکترونهای ظرفیت یکسان مرتب میکنند.
طبقهبندی عناصر
عنصرها معمولاً به دو دسته فلز و نافلز تقسیم بندی میشوند ولی نمیتوان مرز مشخص و کاملاً دقیقی برای آنها تعیین کرد. به طور معمول، عناصر فلزی هادی خوب الکتریسیته و حرارت هستند. زیرگروههای فلزی دیگر هم بر اساس همین خواص مشترک شیمیایی در نظر گرفته شدهاند. به همین علت، عناصر را در قالب گروههای جدول تناوبی بررسی میکنند.
گروههای جدول تناوبی
در جدول مندلیف، هر گروه شامل یک ستون از جدول است و در هر گروه عنصرها دارای خواص مشابهی هستند. جدول تناوبی از هشت گروه اصلی تشکیل شده است که با نامهای ۱، ۲ و ۱۳ تا ۱۸ شناخته میشوند. در ادامه به بررسی هر کدام از گروههای جدول تناوبی میپردازیم. در نظر داشته باشید به غیر از هشت گروه اصلی، گروه 3 تا 12 نیز مورد بررسی قرار میگیرند.
گروه 1: فلزات قلیایی
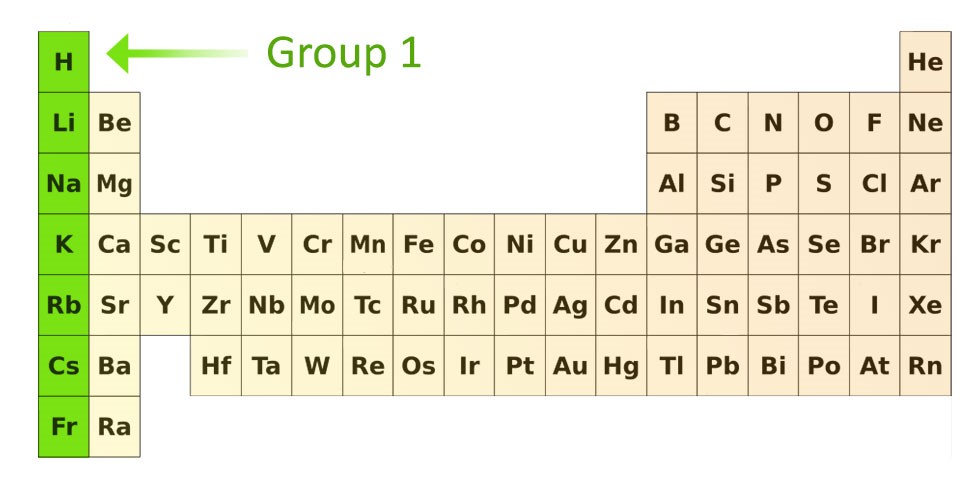
فلزات قلیایی به راحتی یک الکترون از دست میدهند و به کاتیون ۱+ تبدیل میشوند. لیتیوم، سدیم، پتاسیم، روبیدیوم، سزیوم و فرانسیوم در این گروه قرار دارند. این گروه که با نام خانواده لیتیوم نیز شناخته میشوند، براق هستند و به علت خاصیت نرمی که دارند، راخت با چاقو برش داده میشوند. گروه فلزات قلیایی از عنصر لیتیوم شروع شده و با عنصر فرانسیم تمام میشوند. عناصر این گروه به شدت واکنشپذیر هستند و در صورت تماس با آب، به صورت انفجاری واکنش میدهند و حتی شعله هم تولید میکنند. به همین علت، شیمیدانان این عناصر را در داخل روغن، نفت و یا گازهای بی اثر قرار میدهند.
گروه ۲: فلزات قلیایی خاکی
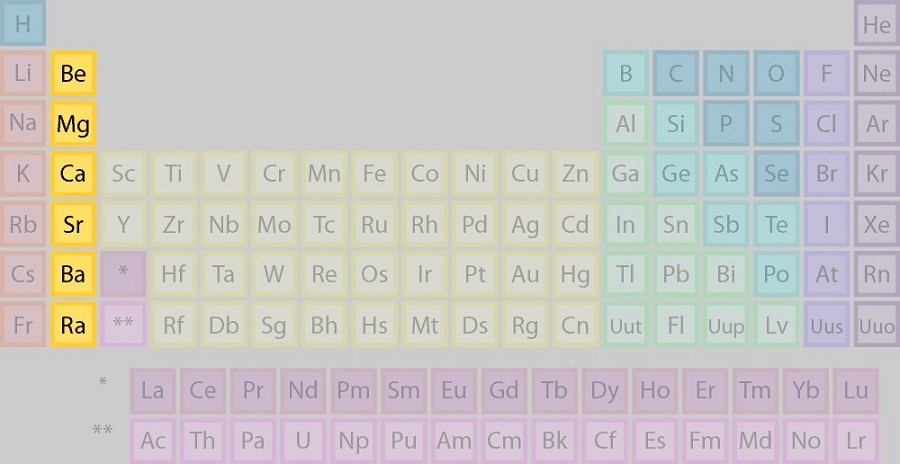
فلزات قلیایی خاکی و یا Alkali Earth Metals گروه دوم جدول تناوبی را تشکیل میدهند. گروه فلزات قلیایی به راحتی دو الکترون از دست میدهند و به کاتیون ۲+ تبدیل میشوند. بریلیوم، منیزیم، کلسیم، استرانسیوم، باریم و رادیوم در این گروه قرار دارند. این فلزات به شدت واکنشپذیر هستند و به راحتی با نافلزها واکنش میدهند و نمک تشکیل میدهند. فلزات قلیایی خاکی به رنگ سفید-نقرهای و براق هستند و به طور کلی چگالی کمی نسبت به سایر فلزات دارند. تمام فلزات قلیایی خاکی دارای دو الکترون در اوربیتال خارجی خود (ns²) هستند.
گروه ۳ تا ۱۲: فلزات واسطه
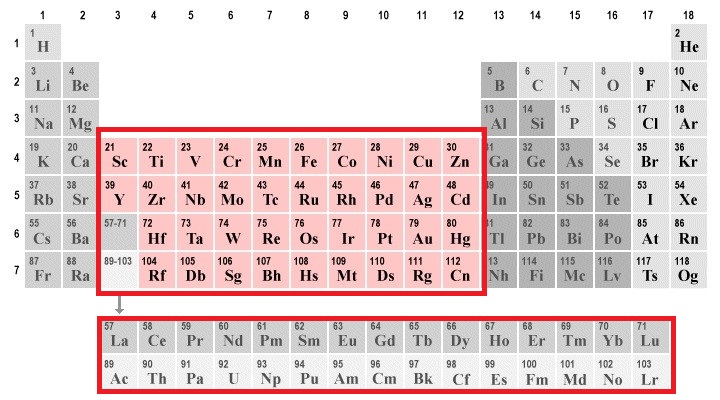
فلزات واسطه (Transition Metals)، عناصری هستند که زیرلایه d آنها به شکل جزئی پر شده است. فلزات واسطه، گروهی از عناصر جذاب و پرکاربرد در جدول مندلیف هستند که در گروههای ۳ تا ۱۲ جای گرفتهاند. این فلزات به دلیل دارا بودن خواص منحصر به فرد، نقش حیاتی در زندگی ما ایفا میکنند. بسیاری از فلزات واسطه به دلیل وجود الکترونهای جفت نشده، خاصیت مغناطیسی دارند. عناصر واسطه دارای استحکام و سختی بالایی هستند و این موضوع به دلیل ساختار اتمی و پیوندهای فلزی قوی بین اتمهای آنها است. فلزات واسطه شامل آهن (Fe)، مس (Cu)، روی (Zn)، نیکل (Ni)، کروم (Cr) و تیتانیوم (Ti) هستند. به طور عامیانهتر این فلزات طلا، نقره، آهن، مس و پلاتین هستند.
لانتانیدها
لانتانیدها، که به عنوان عناصر واسطه داخلی یا فلزات خاکی کمیاب نیز شناخته میشوند، مجموعهای از 15 عنصر شیمیایی هستند که در زیر بلوک f جدول تناوبی قرار دارند. این عناصر شامل:
- لانتان (La)
- سریوم (Ce)
- پراسیودیوم (Pr)
- نئودیمیوم (Nd)
- پرومتیوم (Pm)
- ساماریوم (Sm)
- اروپیم (Eu)
- گادولینیوم (Gd)
- تربیوم (Tb)
- دیسپروزیوم (Dy)
- هولمیوم (Ho)
- اربیوم (Er)
- تولیوم (Tm)
- ایتربیوم (Yb)
- لوتسیوم (Lu)
اکتینیدها
اکتینیدها گروهی از ۱۵ عنصر فلزی هستند که از اکتینیم (با عدد اتمی ۸۹) تا لورنسیم (با عدد اتمی ۱۰۳) در دوره هفتم جدول تناوبی قرار دارند. این نام از نام عنصر اکتینیم گرفته شده است که اولین عنصر در این گروه بود. اکتینیدها در زیر بلوک d و در پایین لانتانیدها در ردیف جداگانهای قرار دارند. این ردیف گاهی اوقات به عنوان “سری اکتینید” یا بلوک f هم شناخته میشود.
گروه ۱۳: خانواده بور
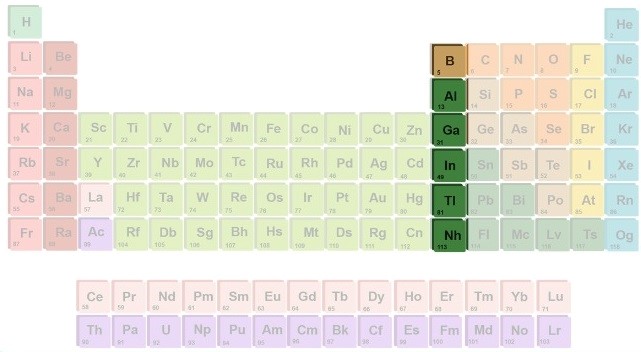
گروه 13 جدول تناوبی، خانواده بور و یا (Boron Family) هستند و عناصر این گروه به دلیل آرایش الکترونی مشابه، خواص شیمیایی مشترکی دارند. عناصر گروه ۱۳ به دلیل تمایل به اشتراکگذاری الکترونها، به طور معمول پیوندهای کووالانسی قوی تشکیل میدهند. این گروه شامل عناصری مانند بور (B) آلومینیوم (Al) گالیم (Ga) ایندیم (In) تالیم (Tl) است.
گروه ۱۴: خانواده کربن
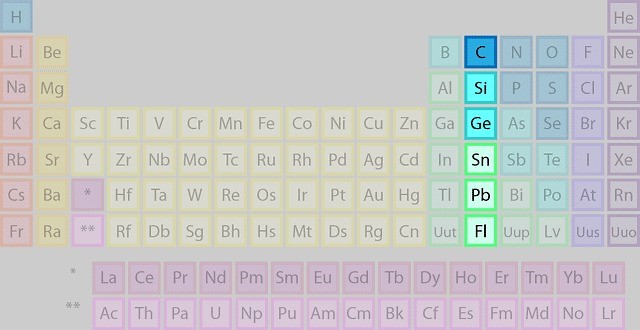
عناصری مانند کربن، سیلیکون (سیلیسیم)، ژرمانیوم، قلع و سرب در گروه پنجم جدول تناوبی قرار دارند. عناصر گروه ۱۴ به دلیل پیکربندی مشابه لایه الکترونی ظرفیت خود، خواص شیمیایی مشترکی دارند. به طور خاص، آنها چهار الکترون ظرفیت دارند که آنها را قادر به تشکیل چهار پیوند کووالانسی میکند. این امر منجر به تنوع قابل توجهی از ترکیبات این عناصر میشود، از جمله مولکولهای آلی، مواد معدنی و نیمههادیها.
گروه ۱۵: گروه نیتروژن
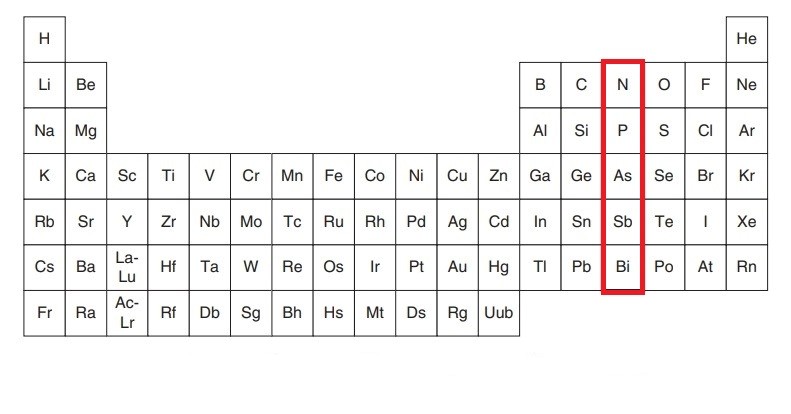
گروه نیتروژن و یا نیکتوژن (Pnictogen) شامل عناصری مانند نیتروژن، فسفر، آرسنیک، آنتیموان، بیسموت و همچنین عنصر مصنوعی مسکوویم است. عناصر این گروه به دلیل آرایش الکترونی مشابه خود، خواص شیمیایی مشترکی دارند. به طور کلی، آنها دارای پنج الکترون ظرفیت در لایه بیرونی خود هستند که آنها را قادر به تشکیل سه پیوند کووالانسی میکند.
گروه 16: گروه اکسیژن (کالکوژنها)
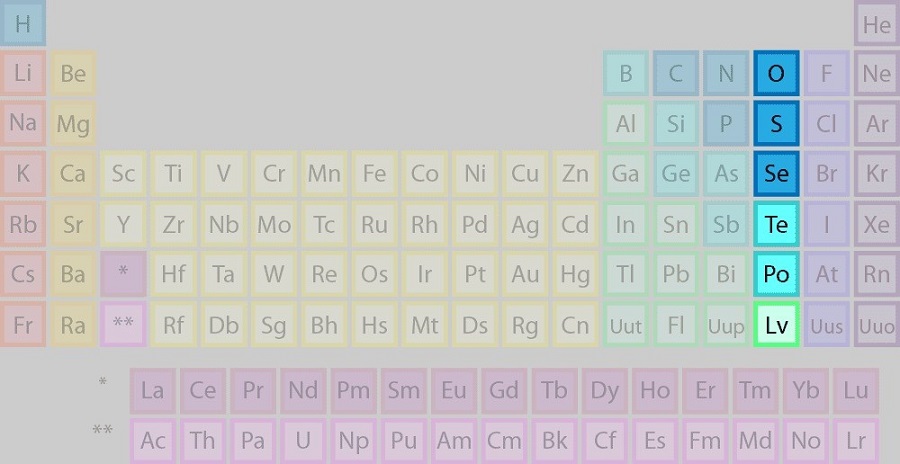
گروه 16، که به عنوان گروه کالکوژن یا خانواده اکسیژن نیز شناخته می شود، یکی از 18 گروه جدول تناوبی عناصر است. این گروه شامل شش عنصر اکسیژن (O)، گوگرد (S)، سلنیوم (Se)، تلوریم (Te)، پولونیوم (Po) و لیورموریوم (Lv)است. کالکوژنها خواص شیمیایی مشابهی دارند زیرا تعداد یکسانی از الکترونها را در لایه ظرفیت خود دارند. آنها تمایل به تشکیل ترکیبات با فلزات دارند و عدد اکسیداسیون آنها می تواند از -2 تا +6 باشد.
گروه ۱۷: هالوژنها
هالوژنها شامل عناصر فلوئور (F) کلر (Cl) برم (Br) ید (I) آستاتین (At) تنسین (Ts)هستند. نام هالوژن از کلمات یونانی hals به معنای نمک و gen به معنای تولید کننده گرفته شده است. زیرا هالوژنها به راحتی با فلزات واکنش میدهند و نمک تشکیل میدهند.
گروه ۱۸: گازهای نجیب
گازهای نجیب، که به عنوان گازهای بیاثر نیز شناخته میشوند، در ستون ۱۸ (گروه ۱۸) جدول تناوبی قرار دارند. این عناصر به دلیل آرایش الکترونی پایدار خود، تمایل بسیار کمی به واکنش با عناصر دیگر نشان میدهند. عناصر این گروه شامل هلیوم (He) نئون (Ne) آرگون (Ar) کریپتون (Kr) زنون (Xe) رادون (Rn) اوگانسون (Og) هستند.
مطلب پیشنهادی: نحوه خواندن شیمی کنکور
اصطلاحات مهم در جدول تناوبی
در این بخش، قصد داریم به بررسی برخی از اصلاحات مهم در جدول مندلیف مثل عدد اتمی، نماد شیمیایی، عدد جرمی و… بپردازیم.
عدد اتمی ( A )
عدد اتمی با نماد Z تعداد پروتونهای موجود در هسته اتم را نشان میدهد. پروتونها ذرات زیراتمی با بار مثبت هستند. عدد اتمی یک عنصر، هویت منحصر به فرد آن عنصر را مشخص میکند و در واقع ملاک قرارگیری هر عنصر در جدول تناوبی است.
برای مثال: هیدروژن (H) دارای 1 پروتون و عدد اتمی 1 است. هلیوم (He) دارای 2 پروتون و عدد اتمی 2 است. اکسیژن (O) دارای 8 پروتون و عدد اتمی 8 است. طلا (Au) دارای 79 پروتون و عدد اتمی 79 است.
عدد جرمی ( Z )
عدد جرمی با نماد (A) یک اتم، تعداد کل نوکلئونها در هسته آن اتم را نشان میدهد. نوکلئونها شامل (پروتونها؛ ذرات زیراتمی با بار مثبت) و (نوترونها؛ ذرات زیراتمی بدون بار) هستند. عدد جرمی یک عنصر، تقریباً برابر با جرم اتمی آن است. جرم اتمی، میانگین جرم ایزوتوپهای یک عنصر است که با واحد واحد جرم اتمی (u) اندازهگیری میشود.
نماد شیمیایی
نماد شیمیایی به انگلیسی (Chemical symbol) یک یا دو حرفی است که به طور قراردادی و بینالمللی به هر عنصر شیمیایی اختصاص داده میشود. هر عنصر با یک نماد شیمیایی منحصربهفرد شناخته میشود که معمولاً از اولین حرف یا دو حرف اول نام آن عنصر به زبان لاتین گرفته شده است.
دوره
ردیفهای افقی در جدول تناوبی را دوره مینامند. به طور کلی، عناصر در یک دوره خواص شیمیایی مشابهی دارند.
بلوک ها
جدول تناوبی به چهار بلوک s، p، d و f تقسیم می شود که بر اساس نحوه پر شدن اوربیتال های اتمی توسط الکترون ها طبقه بندی میشوند.
الکترونگاتیویتی
به تمایل یک اتم برای جذب الکترون از اتم دیگر الکترونگاتیویتی میگویند.
ایزوتوپها
ایزوتوپها، اتمهایی از یک عنصر با همان عدد اتمی اما تعداد جرمی متفاوت هستند. ایزوتوپها میتوانند پایدار یا ناپایدار (رادیواکتیو) باشند.
مطلب پیشنهادی: روشهای تست زنی در کنکور
سخن نهایی

جدول تناوبی یا جدول مندلیف، یک ساختار کامل است که تمامی عناصر کشف شده طبق نظم مشخصی در آن چیده شدهاند. جدول تناوبی به صورت عمودی به ۱۸ گروه تقسیم میشود و هر گروه شامل عناصری است که تعداد الکترونهای آن ظرفیت یکسانی در آخرین لایه (لایه ظرفیت) خود دارند. به عنوان مثال، تمام عناصر گروه ۱ (فلزات قلیایی) یک الکترون ظرفیت دارند و به همین دلیل بسیار واکنشپذیر بوده و به راحتی با سایر عناصر ترکیب میشوند. در مقابل، تمام عناصر گروه ۱۸ (گازهای نجیب) دارای ۸ الکترون ظرفیت بوده و تمایل بسیار کمی به واکنش با سایر عناصر دارند. در این مقاله به طور دقیق به بررسی هر کدام از گروههای جدول تناوبی پرداختیم و امیدواریم از خواندن این مقاله لذت برده باشید.
-
21 آبان 1403
عالی بود ♥️♥️♥️♥️♥️♥️♥️♥️







.svg)